Glomeruläre Nierenoberfläche
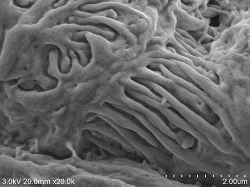
Präparartionsbedingungen (4° C): Nach Fixation mit 2% Glutaraldehyd Perfusion, geschnitten (Dicke ca. 0,5 mm) und 2. Fixierung ⇒ 1% Osmiumtetroxid Fixierung 2 Stunden ⇒ DW 10 Minuten, 6x ⇒ 1% Tanninsäure wässrige Lösung, 3 Stunden ⇒ DW 10 Minuten, 6x ⇒ 1% Osmiumtetroxid Fixierung 2 Stunden ⇒ DW 10 Minuten, 3x ⇒ 2% BEL-1 (70% Ethanol) 1,5 Stunden eingetaucht ⇒ Gebläse, Kaltluft-getrocknet, Untersuchungsbedingungen: SE-Detektor, Beschleunigungsspannung 3KV, WD20, Emissionsstrom (0,8 bis 4,7 μA) |
Glomeruläre Rattenniere

Präparartionsbedingungen (4° C): Nach Fixation mit 2% Glutaraldehyd Perfusion, geschnitten (Dicke ca. 0,5 mm) und 2. Fixierung ⇒ 1% Osmiumtetroxid Fixierung Stunden ⇒ DW 10 Minuten, 6x ⇒ 1% Tanninsäure wässrige Lösung, 3 Stunden ⇒ DW 10 Minuten, 6x ⇒ 1% Osmiumtetroxid Fixierung 2 Stunden ⇒ DW 10 Minuten, 3x ⇒ 2% BEL-1 (70% Ethanol) 1,5 Stunden eingetaucht ⇒ Gebläse, Kaltluft-getrocknet, Untersuchungsbedingungen: SE-Detektor, Beschleunigungsspannung 3KV, WD20, Emissionsstrom (0,8 bis 4,7 μA) |
Rattenniere proximal tubule (Bürstenrand)

Präparartionsbedingungen (4° C): Nach Fixation mit 2% Glutaraldehyd Perfusion, geschnitten (Dicke ca.. 0,5 mm) und 2. Fixierung ⇒ 1% Osmiumtetroxid Fixierung 2 Stunden ⇒ DW 10 Minuten, 6x ⇒ 1% Tanninsäure wässrige Lösung 3 Stunden ⇒ DW 10 Minuten, 6x ⇒ 1% Osmiumtetroxid Fixierung 2 Stunden ⇒ DW 10 Minuten, 3x ⇒ 2% BEL-1 (70% Ethanol) 1,5 Stunden eingetaucht ⇒ Gebläse, Kaltluft-getrocknet, Untersuchungsbedingungen: SE-Detektor, Beschleunigungsspannung 3KV, WD20, Emissionsstrom (0,8 bis 4,7 μA) |
Rattenniere Glomeruläres Schnittbild (innere Oberfläche des Blutgefäßes)

Präparartionsbedingungen (4° C): Nach Fixation mit 2% Glutaraldehyd Perfusion, geschnitten (Dicke ca. 0,5 mm) and 2. Fixierung ⇒ 1% Osmiumtetroxid Fixierung 2 Stunden ⇒ DW 10 Minuten, 6x ⇒ 1% Tanninsäure wässrige Lösung 3 Stunden ⇒ DW 10 Minuten, 6x ⇒ 1% Osmiumtetroxid Fixierung 2 Stunden ⇒ DW 10 Minuten, 3x ⇒ 2% BEL-1 (70% Ethanol) 1,5 Stunden eingetaucht ⇒ Gebläse, Kaltluft-getrocknet, Untersuchungsbedingungen: SE-Detektor, Beschleunigungsspannung 3KV, WD20, Emissionsstrom (0,8 bis 4,7 μA) |
Rattenniere Proximaler Tubulus (Bürstenrand)

Präparartionsbedingungen (4° C): Nach Fixation mit 2% Glutaraldehyd Perfusion, geschnitten (Dicke ca. 0,5 mm) und 2. Fixierung ⇒ 1% Osmiumtetroxid Fixierung 2 Stunden ⇒ DW 10 Minuten, 6x ⇒ 1% Tanninsäure wässrige Lösung 3 Stunden ⇒ DW 10 Minuten, 6x ⇒ 1% Osmiumtetroxid Fixierung 2 Stunden ⇒ DW 10 Minuten, 3x ⇒ 2% BEL-1 (70% Ethanol) 1.5 Stunden eingetaucht ⇒ Gebläse, Kaltluft-getrocknet
Untersuchungsbedingungen: SE-Detektor, Beschleunigungsspannung 3KV, WD20, Emissionsstrom (0,8 bis 4,7 μA) |
Rattenleber Gallenkanal

Präparartionsbedingungen (4° C): Nach Fixation mit 2% Glutaraldehyd Perfusion, geschnitten (Dicke ca. 0,5 mm) und 2. Fixierung ⇒ 1% Osmiumtetroxid Fixierung 2 Stunden ⇒ DW 10 Minuten, 6x ⇒ 1% Tanninsäure wässrige Lösung 3 Stunden ⇒ DW 10 Minuten, 6x ⇒ 1% Osmiumtetroxid Fixierung 2 Stunden ⇒ DW 10 Minuten, 3x ⇒ 2% BEL-1 (70% Ethanol) 1.5 Stunden eingetaucht ⇒ Gebläse, Kaltluft-getrocknet
Untersuchungsbedingungen: SE-Detektor, Beschleunigungsspannung 3KV, WD20, Emissionsstrom (0,8 bis 4,7 μA) |
Rattenleber Gefäßendothelzellen
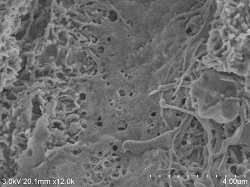
Präparartionsbedingungen (4° C): Nach Fixation mit 2% Glutaraldehyd Perfusion, geschnitten (Dicke ca. 0,5 mm) und 2. Fixierung ⇒ 1% Osmiumtetroxid Fixierung 2 Stunden ⇒ DW Minuten, 6x ⇒ 1% Tanninsäure wässrige Lösung 3 Stunden ⇒ DW 10 Minuten, 6x ⇒ 1% Osmiumtetroxid Fixierung 2 Stunden ⇒ DW 10 Minuten, 3x ⇒ 2% BEL-1 (70% Ethanol) 1,5 Stunden eingetaucht ⇒ Gebläse, Kaltluft-getrocknet Untersuchungsbedingungen: SE-Detektor, Beschleunigungsspannung 3KV, WD20, Emissionsstrom (0,8 bis 4,7 μA) |
Ratte Microvilli

Präparartionsbedingungen (4° C): Nach Fixation mit 2% Glutaraldehyd, geschnitten (Dicke ca. 0,5 mm) und 2. Fixierung ⇒ Fixierung mit 1% Osmiumtetroxid 2 Fixierung ⇒ DW 10 Minuten, 6x ⇒ 1% Tanninsäure wässrige Lösung 3 Stunden ⇒ DW 10 Minuten, 6x ⇒ 1% Osmiumtetroxid Fixierung 2 Stunden ⇒ DW 10 Minuten, 3x ⇒ 2% BEL-1 (70% Ethanol) 1,5 Stunden eingetaucht ⇒ Gebläse, Kaltluft-getrocknet Untersuchungsbedingungen: SE-Detektor, Beschleunigungsspannung 3KV, WD20, Emissionsstrom (0,8 bis 4,7 μA) |
Rattenniere Glomeruläres Schnittbild (innere Oberfläche des Blutgefäßes)

Doppelfixierung ⇒ 5% BEL-1 (70% Ethanol) eingetaucht für 2 Stunden ⇒ Trocknung (Gebläse, Kaltluft-getrocknet) |
Proximaler Tubulus (Bürstenrand)
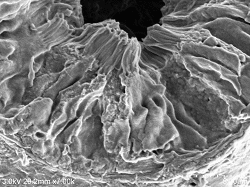
Doppelfixierung ⇒ 5% BEL-1 (70% Ethanol) eingetaucht für 2 Stunden ⇒ Trocknung (Gebläse, Kaltluft-getrocknet) |
|
|
Rattenniere Renale Glomeruli

Doppelfixierung ⇒ 5% BEL-1 (70% Ethanol) eingetaucht für 2 Stunden ⇒ Trocknung (Gebläse, Kaltluft-getrocknet) |
Rattenniere proximal tubule (brush border)

Doppelfixierung ⇒ 5% BEL-1 (70% Ethanol) eingetaucht für 2 Stunden ⇒ Trocknung (Gebläse, Kaltluft-getrocknet) |
RattenniereGlomeruläre Nierenoberfläche
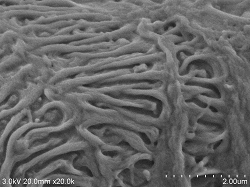
Doppelfixierung ⇒ 5% BEL-1 (70% Ethanol) eingetaucht für 2 Stunden ⇒ Trocknung (Gebläse, Kaltluft-getrocknet) |
Dünndarm bei Ratten Weicher überstand

Doppelfixierung ⇒ 5% BEL-1 (70% Ethanol) eingetaucht für 2 Stunden ⇒ Trocknung (Gebläse, Kaltluft-getrocknet) |
Rattenleber Gallenkanal
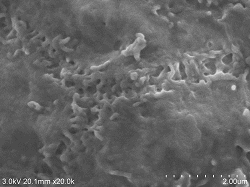
Doppelfixierung ⇒ 5% BEL-1 (70% Ethanol) eingetaucht für 2 Stunden ⇒ Trocknung (Gebläse, Kaltluft-getrocknet) |
Rattenleber Gefäßendothelzellen
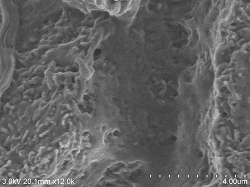
Doppelfixierung ⇒ 5% BEL-1 (70% Ethanol) eingetaucht für 2 Stunden ⇒ Trocknung (Gebläse, Kaltluft-getrocknet) |
Neutrophile

1% GA Fixation (Trägerglas mit PLL Beschichtung) 30 Minuten Adhesion (nass) ⇒ DW ⇒ 10% BEL-1 (Verdünnte Lösung: 100% Ethanol) 10 Minuten eingetaucht ⇒ Trocknung (Gebläse → Kaltluft-getrocknet ca. 15 Minuten) Untersuchungsbedingungen: SE-Detektor, oberer Emissionsstrom 5.5μA |
Kieselalgen

2% GA Fixierung ⇒ DW ⇒ 10% BEL-1 (70% Ethanol) 10 Minuten eingetaucht ⇒ Trocknung (Gebläse, Kaltluft-getrocknet) Untersuchungsbedingungen: Beschleunigungsspannung 3KV, Emissionsstrom: 5.5μA SE-Detektor: Mix |
Kieselalgen

1% GA ⇒ DW ⇒ 10% BEL-1 (70% Ethanol) 10 Minuten ⇒ Trocknung (Kaltluft-getrocknet) |
Kieselalgen

1% GA ⇒ DW ⇒ 10% BEL-1 (70% Ethanol) 10 Minuten ⇒ Trocknung (Kaltluft-getrocknet) |
Megalopa-Larve

1% GA ⇒ DW ⇒ 10% BEL-1 (70% Ethanol) 10 Minuten ⇒ Trocknung (Kaltluft-getrocknet) |
Megalopa-Larve

1% GA ⇒ DW ⇒ 10% BEL-1 (70% Ethanol) 10 Minuten ⇒ Trocknung (Kaltluft-getrocknet) |
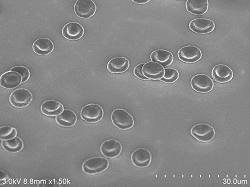
Rote Blutkörperchen

10% (Verdünnte Lösung: 100% Ethanol) 10 Minuten eingetaucht, Beschleunigungsspannung 3kV Emissionsstrom 5,5μA, SE-Detektor |
Weiße Blutkörperchen
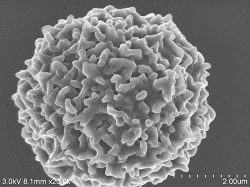
10% (Verdünnte Lösung: 100% Ethanol) 10 Minuten eingetaucht, Beschleunigungsspannung 3kV Emissionsstrom 5,5μA, SE-Detektor |
Auf REM Probenteller
1% GA Fixation (Auf REM Probenteller) 30 Minuten Adhesion (nass) ⇒ DW ⇒ 10% BEL-1 (Verdünnte Lösung: 70% Ethanol) 10 Minuten eingetaucht ⇒ Trocknung (Gebläse → Kaltluft-getrocknet ca. 15 Minuten) Untersuchungsbedingungen: SE-Detektor oberer Emissionsstrom 5,5μA |
Auf REM Probenteller

1% GA Fixation (Auf REM Probenteller) 30 Minuten Adhesion (nass) ⇒ DW ⇒ 10% BEL-1 (Verdünnte Lösung: 70% Ethanol) 10 Minuten eingetaucht ⇒ Trocknung (Gebläse → Kaltluft-getrocknet ca. 15 Minuten) Untersuchungsbedingungen: SE-Detektor oberer Emissionsstrom 5,5μA |
Auf REM Probenteller

1% GA Fixation (Auf REM Probenteller) 30 Minuten Adhesion (nass) ⇒ DW ⇒ 10% BEL-1 (Verdünnte Lösung: 70% Ethanol) 10 Minuten eingetaucht ⇒ Trocknung (Gebläse → Kaltluft-getrocknet ca. 15 Minuten) Untersuchungsbedingungen: SE-Detektor, oberer Emissionsstrom 5,5 μA |
Auf REM Probenteller
 < <
1% GA Fixation (Auf REM Probenteller) 30 Minuten Adhesion (nass) ⇒ DW ⇒ 10% BEL-1 (Verdünnte Lösung: 70% Ethanol) 10 Minuten eingetaucht ⇒ Trocknung (Gebläse → Kaltluft-getrocknet ca. 15 Minuten) Untersuchungsbedingungen: SE-Detektor, oberer Emissionsstrom 5,5 μA |
Courtesy of St. Marianna University School of Medicine, Electron Microscope Research Facility Chisako Sasaki


































 <
<